reaktionslehre
Dies ist eine alte Version des Dokuments!
Inhaltsverzeichnis
Reaktionslehre
Reaktionsgeschwindigkeit
Begriffe & Definitionen
Die Reaktionsgeschwindigkeit in der Chemie ist die Änderung der Konzentration einer Lösung oder der Stoffmenge sowie Masse eines Stoffes bei einer chemischen Reaktion in Abhängigkeit der Zeit. Während einer chemischen Reaktion ändert sich die Reaktionsgeschwindigkeit.1) $$v = \frac{Δc}{Δt}$$
- Der Reaktionsmechanismus ist die Abfolge von Einzelschritten, wie eine chemische Reaktion auf Teilchenebene abläuft. Erzeigt z.B., welche Bindungen wann gebrochen oder gebildet werden.
- Bei einem wirksamen Zusammenstoss, stossen Teilchen richtig orientiert und mit genügend Energie zusammen, sodass es zu einer Reaktion kommt.
- Bei einem unwirksamen Zusammenstoss, stossen Teilchen zwar zusammen, sind jedoch entweder nicht richtig orientiert oder haben nicht genügend Energie (oder beides), sodass keine Reaktion stattfindet.
- Die Aktivierungsenergie ΔEA ist die Mindestenergie, die Teilchen benötigen, damit ein wirksamer Zusammenstoss und somit eine Reaktion möglich ist.
- Die Reaktionsenergie ΔER ist die Energiedifferenz zwischen Produkten und Edukten. Sie zeigt, ob eine Reaktion exotherm (Energie wird frei) oder endotherm (Energie wird aufgenommen) ist.
Abhängigkeiten der Reaktionsgeschwindigkeit
- Je grösser die Oberfläche ist, desto mehr Teilchen sind frei zugänglich und somit verfügbar für Zusammenstösse.
- Bei einer höheren Konzentration existieren mehr Teilchen pro Volumen, was zu mehr Zusammenstössen führt und somit zu einer höheren Wahrscheinlichkeit für eine Reaktion.
- Wenn die Temperatur steigt, steigt auch die kinetische Energie und somit die Geschwindigkeit der Teilchen. Das führt ebenfalls zu mehr Zusammenstössen und somit zu einer höheren Wahrscheinlichekeit für eine Reaktion.
- Ein Katalysator verändert den Reaktionsweg, sodass die Aktivierungsenergie niedriger ist. Dadurch schaffen es mehr Teilchen mit ihrer vorhandenen Energie zu reagieren.
Katalysator
Als Katalysator wird in der Chemie ein Stoff bezeichnet, der die Reaktionsgeschwindigkeit einer chemischen Reaktion beeinflusst [, indem er die Aktivierungsenergie senkt], ohne dabei selbst verbraucht zu werden. Der Katalysator liegt also nach der Reaktion unverändert vor.2)
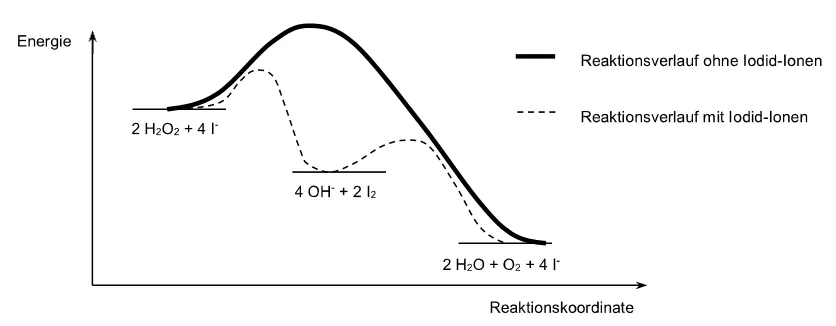
Energieumsatz
- […] Energie [ist] die Fähigkeit, Arbeit zu verrichten, Licht auszustrahlen oder Wärme abzugeben.3)
- kinetische Energie
- potentielle Energie
- thermische Energie
- elektrische Energie
- Strahlungsenergie
- Bindungsenergie ist die Energie, die benötigt wird, um eine chemische Bindung zu trennen. Zwei Wasserstoffatome (H) teilen sich ein Elektronenpaar und bilden so eine Elektronenpaarbindung. Um das H2-Molekül wieder in zwei einzelne H-Atome zu zerlegen, muss man Bindungsenergie zuführen – beim H2-Molekül sind das etwa 436 kJ/mol.
Triebkräfte
reaktionslehre.1746462708.txt.gz · Zuletzt geändert: 2025/05/05 12:31 von webmaster
